学院新闻
Nature Communications | 周菁课题组与合作者发现盘状结构域受体1(DDR1)是内皮细胞中新的力学感受器
2023年10月13日,北京大学医学部JDB电子官方网站生理学与病理生理学系周菁课题组与中科院生物物理研究所李伟课题组合作在Nature Communications杂志在线发表了题为Endothelial Discoidin Domain Receptor 1 Senses Flow to Modulate YAP Activation的研究论文。该研究首次发现并证明了盘状结构域受体DDR1可以充当内皮细胞中直接的力学感受器,并通过单分子磁镊技术解析了DDR1在力学刺激后发生构象改变的关键结构域。

血流剪切力在血管生成、血管稳态和动脉粥样硬化疾病中发挥着关键作用。力学感受器作为细胞外力学信号的“第一响应者”,负责将力学信号转化为细胞内的生物化学信号,从而影响一系列的细胞行为。因此,探索并发现新的力学感受器以及解析其力学感知的结构基础对治疗心血管疾病具有重要意义。
该课题组的前期研究发现,酪氨酸激酶受体家族成员——盘状结构域受体1(DDR1)可以充当平滑肌细胞中的基质刚度感受器(Bioactive Materials 2022),并可以在生化和机械信号的刺激下发生“液-液相分离”(LLPS)这种细胞内很多重要生命过程——包括无膜细胞器的形成等——的关键过程,从而调控下游信号通路(Circulation Research 2023)。然而,DDR1能否介导内皮细胞对血流剪切力的响应尚不清楚。在此项研究中,研究者通过平行板流动腔和微流控模型在体外模拟层流和扰流,证明了DDR1参与了内皮细胞对血流剪切力的功能响应。此外,研究者还构建了内皮特异性Ddr1敲除小鼠,对其进行了左颈动脉部分结扎,3天后通过尾静脉注射AAV8-PCSK9病毒,并给予高胆固醇饮食以诱导动脉粥样硬化。结果显示,Ddr1敲除显著抑制了血管内膜炎性粘附分子的表达和动脉粥样硬化斑块形成。
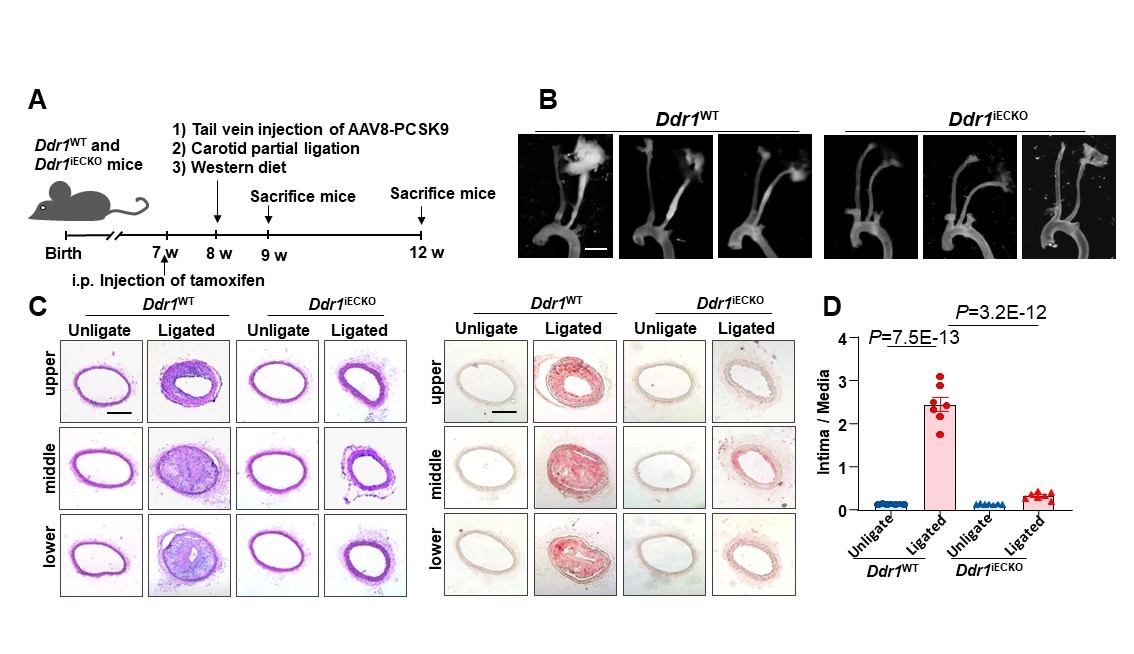
图1. Ddr1内皮特异性敲除缓解扰流加速的动脉粥样硬化
为了证明DDR1能直接感受力学刺激,研究者通过包被DDR1配体或者抗体的磁珠对内皮细胞表面的DDR1蛋白特异性地施加皮牛级的拉力,然后观察DDR1能否被激活。结果显示,在包被胶原蛋白或者DDR1抗体的磁珠的牵拉下,可在磁珠周围观察到明显的DDR1凝聚体形成。接下来,为了解析DDR1力学感知的关键结构域,研究者通过单分子磁镊技术对DDR1胞外域蛋白的解折叠动力学进行了解析。结果显示,DDR1胞外的DS-like结构域的开放构象对DDR1的力学响应十分重要。
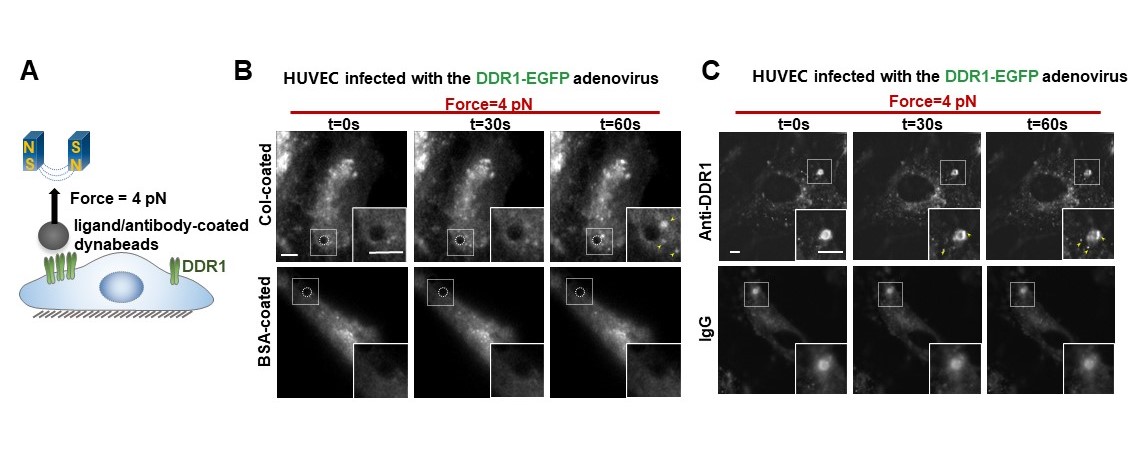
图2. DDR1可以直接感受力学刺激
最后,研究者通过免疫共沉淀联合质谱技术,探究了DDR1会与哪些下游蛋白相互作用,并筛选出64种在OS/PS条件下与DDR1结合显著变化的蛋白质。通过蛋白相互作用网络分析,研究者关注到了位于此网络核心的YWHAE(14-3-3ε)蛋白。值得一提的是,14-3-3蛋白家族已被报道可以调控其结合伴侣的液-液相分离,且14-3-3ε可以与胞浆中磷酸化的YAP结合并导致其降解。通过体外相分离、荧光漂白恢复和活细胞成像、Co-IP和免疫荧光等技术,此研究进一步证明了活化的DDR1可以通过与14-3-3ε共同相分离,从而隔离了14-3-3ε,促进了YAP的稳定性和入核,进而促进了动脉粥样硬化的发生发展。
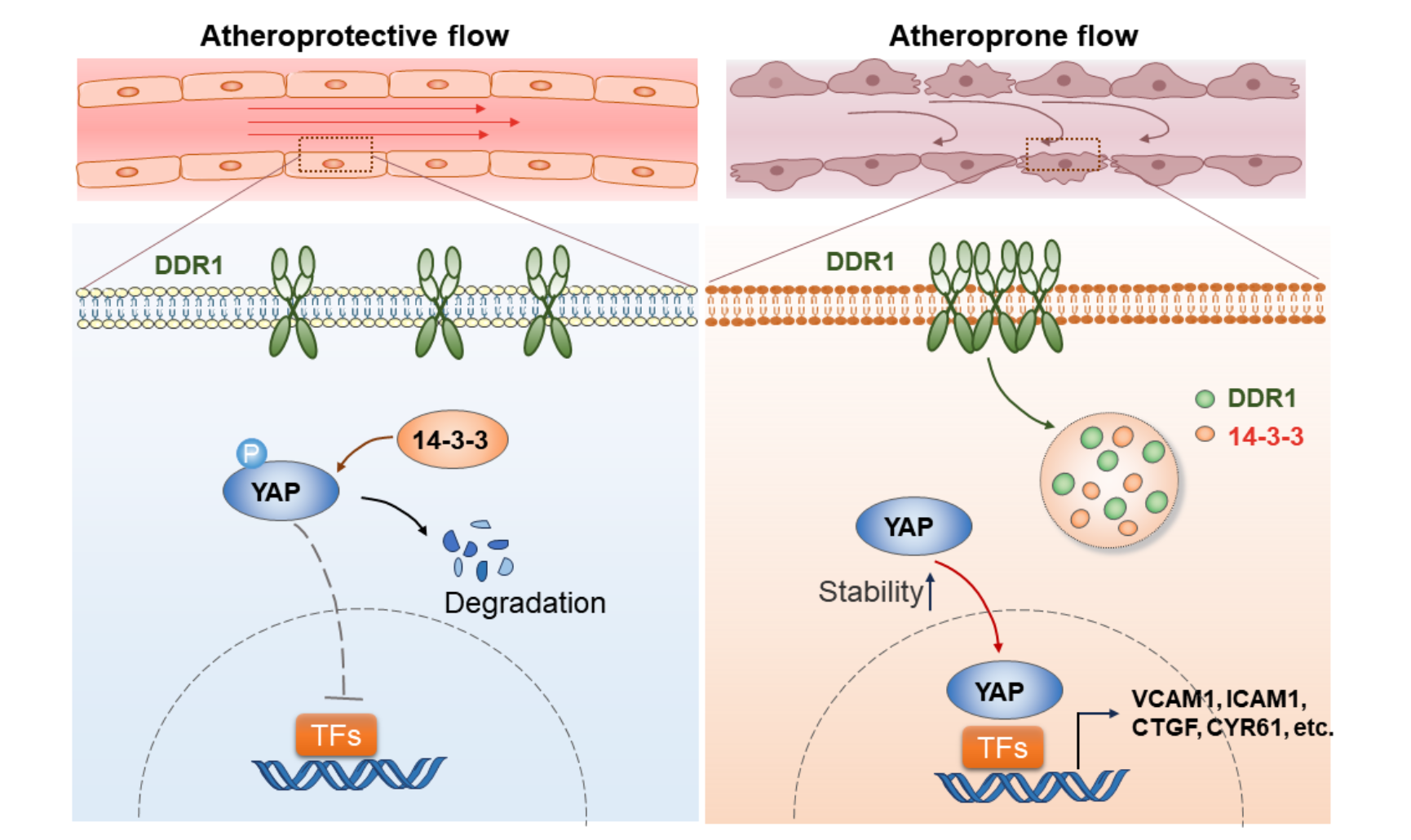
图3. DDR1感知不同模式的流体剪切力,以受体相分离启动机械信号转导,调控YAP活化
北京大学JDB电子官方网站生理学与病理生理学系博士生刘佳钰和博士后赵川榕为该论文的共同第一作者,北京大学生理学与病理生理学系周菁研究员和中科院生物物理研究所李伟研究员为共同通讯作者。该工作还得到了大连理工大学刘波教授和北京大学生理学与病理生理学系张炜真教授的帮助,并得到北京大学医学部医药卫生分析中心共聚焦成像平台和天然药物及仿生药物国家重点实验室质谱平台的技术支持。该研究受到国家自然科学基金和中国科学院战略性先导科技专项的资助。
原文链接:https://www.nature.com/articles/s41467-023-42341-z

