学院新闻
孔炜和付毅课题组与合作者研发新型抗动脉粥样硬化疫苗
2022年12月23日,北京大学JDB电子官方网站生理学与病理生理学系孔炜教授和付毅研究员团队,在心血管领域权威期刊《Circulation》在线发表了题为“Peptide Vaccine Against ADAMTS-7 Ameliorates Atherosclerosis and Postinjury Neointima Hyperplasia”的研究论文,研发了降脂非依赖的靶向金属蛋白酶ADAMTS-7的新型抗动脉粥样硬化疫苗。
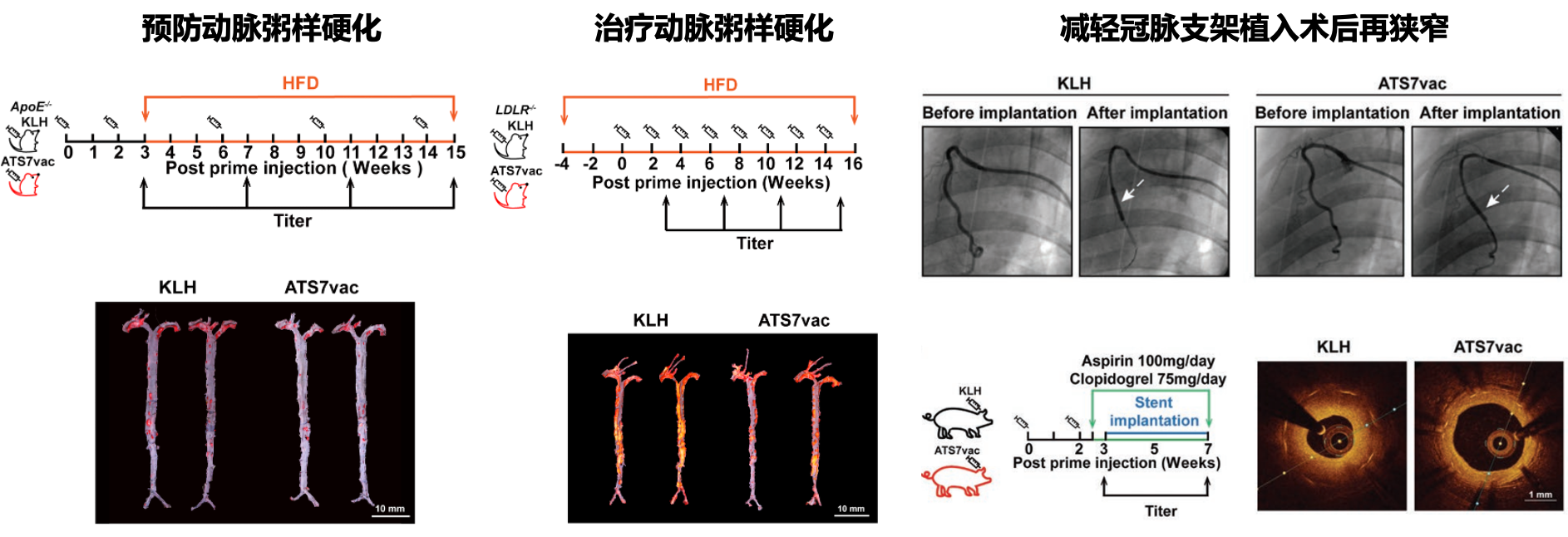
心血管疾病是我国居民的首要死因,而超过60%的心血管死亡事件与动脉粥样硬化相关。目前临床上干预动脉粥样硬化主要依赖降血脂和晚期血管内支架。然而,降脂仅缓解不到1/3的动脉粥样硬化相关急性心血管事件;而支架植入存在再狭窄和支架内血栓形成的风险。是否有其他的新干预策略?金属蛋白酶ADAMTS-7是孔炜教授课题组克隆并发现的一个新的致动脉粥样硬化基因,ADAMTS-7通过降解细胞外基质的特异底物促进了动脉粥样硬化及其相关的再狭窄的病变。因此,ADAMTS-7是一个抗动脉粥样硬化的潜在靶点。该研究利用短肽疫苗的策略,通过B细胞抗原表位预测和小鼠动脉再狭窄模型的功能验证,筛选得到1个有效疫苗肽段,通过与钥匙蓝蛋白KLH偶联,辅以氢氧化铝,构成抗ADAMTS-7的短肽疫苗(ATS7vac)。在动脉粥样硬化小鼠模型中,无论是造模前预先皮下免疫,还是造模后在病程中给予ATS7vac,均可在不影响血脂的基础上有效抑制动脉粥样硬化的发生发展,说明ATS7vac具有降脂非依赖的预防和治疗动脉粥样硬化的保护作用;而在巴马小型猪冠脉支架植入模型中,利用光学相干断层扫描(OCT)发现预先通过皮下免疫ATS7vac,可显著减少支架植入后再狭窄。同时,在免疫后的动物中还排除了疫苗诱发的造血系统和主要脏器的免疫损害。进一步,该研究分离纯化免疫后巴马猪产生的多克隆抗体,发现该抗体特异识别ADAMTS-7的酶活性结构域,而不识别其他ADAMTS成员;并且免疫产生的多克隆抗体可有效抑制ADAMTS-7的酶活性,即抑制ADAMTS-7对基质蛋白COMP的降解减轻血管平滑肌细胞迁移,而抑制ADAMTS-7对基质蛋白TSP-1的降解促进内皮的修复。多克隆抗体对血管平滑肌细胞和内皮细胞的双重作用,也进一步提示ATS7vac不仅是一个不依赖降脂的抗动脉粥样硬化及相关再狭窄病变的新型疫苗,并且还可能规避目前临床药物涂层支架导致的血栓风险。
慢病疫苗是近年来新兴的一种非常具有临床转化前景的针对非感染性疾病的干预策略。与单抗药物相比,其具有给药次数少,患者依从性高以及成本低的潜在优点。现有针对动脉粥样硬化的疫苗研发主要集中于降脂的靶点。该研究研发的ATS7vac以血管本身的重构病变为靶点,是现有临床上降脂为主的抗动脉粥样硬化治疗策略的有效补充。
北京大学JDB电子官方网站人体生理学专业马子涵博士和毛晨峰博士为该论文的共同第一作者,北京大学JDB电子官方网站生理学与病理生理学系孔炜教授和付毅研究员,中日友好医院心内科郑金刚主任和华中科技大学同济医学院附属协和医院心内科廖玉华主任为共同通讯作者。该工作还得到北京大学王宪教授、尹艳慧研究员,浙江大学徐清波教授和纽约大学医学院Chuanju Liu教授等的支持与帮助。该项研究获得国家自然科学基金创新群体、优秀青年基金项目和国家重点研发计划等经费资助。

