学院新闻
Cell Meta|强力/汪丽恒团队揭示抗体IgG累积驱动衰老的新机制
衰老一直是科学家试图解码的生理谜题,而近日北京大学JDB电子官方网站的强力教授研究团队与汪丽恒教授团队合作,带来了一项颠覆性的发现,揭示了衰老的一个新的驱动因子:IgG,免疫系统中的主要抗体。

衰老作为慢性疾病和机体功能衰退的主要原因,一直是全球面临的最大的健康挑战之一。虽然长期以来我们知道随着年龄增长,身体的各种机能会逐渐下降,但是衰老过程的具体驱动因子一直是个谜。科学家们通过对年老和年轻老鼠的实验发现了“长寿因子”和“衰老因子”,但对于衰老的具体机制了解甚少。
以小鼠为例,衰老的表型往往在小鼠24个月龄后显著,而代谢的衰退则更早地开始发生,如胰岛素抵抗,在小鼠12个月龄(相当于人类40岁)已经显著。脂肪组织作为全身最主要的代谢器官,在衰老过程中最早、最显著地发生衰老相关基因表达变化(Cell Reports, 2020)。然而,脂肪组织的病理退化以及其背后的驱动因子和作用机制一直是个谜。
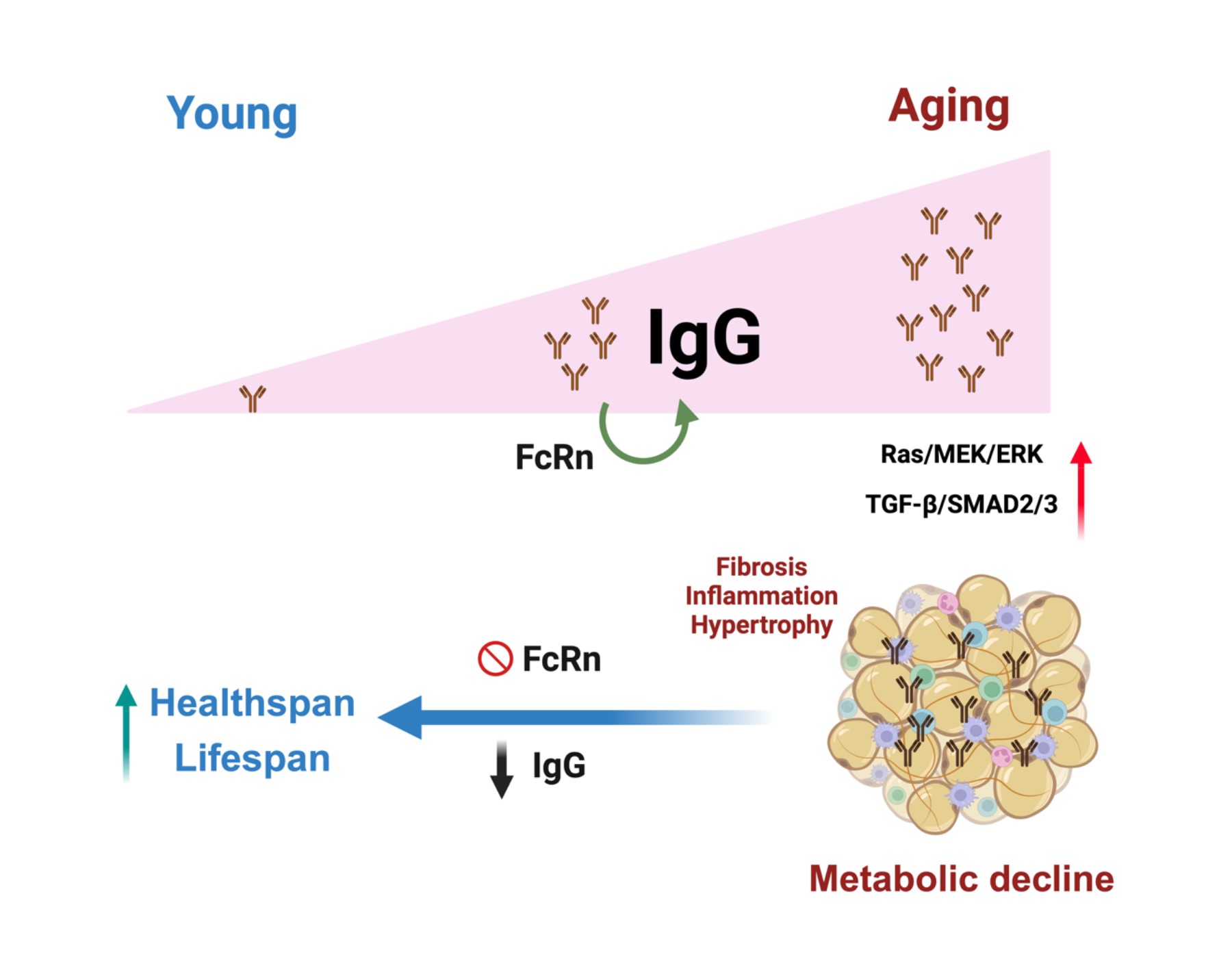
2024年2月19日,北京大学JDB电子官方网站的强力教授研究团队与汪丽恒教授团队合作,在Cell Metabolism杂志上发表了题为‘IgG is an aging factor that drives adipose tissue fibrosis and metabolic decline’ 的文章。该研究发现,IgG在衰老的早期就开始在全身累积,尤其是在脂肪组织中,并逐渐导致脂肪组织纤维化和代谢损伤。而干预IgG的累积可以显著改善衰老中的代谢衰退,延长健康寿命。
为深入理解其影响,研究人员比较年轻和衰老脂肪组织的定量蛋白组发现35-60kDa范围蛋白改变最明显,而其中显著富集的蛋白中有半数的蛋白分子是免疫球蛋白(Igs)。研究人员通过量化比较脂肪组织中免疫球蛋白发现,衰老的脂肪组织中免疫球蛋白(IgG)水平上调了近20倍。且在众多组织中,白色脂肪组织的IgG是变化最为显著的。有趣的是,研究人员采用经典的衰老改善措施限制饮食(CR)处理衰老小鼠,发现CR处理的衰老的小鼠白色脂肪组织中IgG的水平得到显著清除。而外源IgG干预处理会显著损伤CR所改善的IgG清除、脂肪组织的健康、机体胰岛素的代谢敏感性等。
研究人员还发现IgG在衰老中的具体作用机制。是通过激活巨噬细胞的炎症反应,IgG刺激后者释放TGF-β因子,诱导脂肪细胞前体细胞的纤维化,导致脂肪组织纤维化,最终损伤脂肪组织的代谢功能。研究人员通过特异性敲除巨噬细胞中的IgG循环调节受体FcRn,成功抑制了IgG在衰老过程中的积累,显著改善了脂肪组织纤维化和代谢功能,延长了健康寿命。这一发现为对抗衰老提供了新的策略,研究人员测试了IgG/FcRn作为靶点干预衰老中代谢损伤的可能性。通过FcRn的反义寡核苷酸处理衰老的小鼠,可以显著改善脂肪组织纤维化和代谢功能。
虽然IgG在体内对免疫保护至关重要,但其过度累积却可能导致脂肪组织慢性炎症、纤维化和脂肪细胞功能受损,进而引发全身代谢衰退。因此,这一研究为我们提供了一个新的观念,即免疫保护可能是通过代谢衰退来付出的代价。这也为衰老和免疫代谢研究提供了新的方向。
北京大学强力教授和汪丽恒教授为本研究的共同通讯作者。美国哥伦比亚大学于乐祥博士为本文第一作者。强力教授回国前任职于美国哥伦比亚大学,现任职北京大学JDB电子官方网站药理学系,主要从事代谢和衰老相关的机制研究和转化探索。汪丽恒教授系北京大学心血管所研究员,主要从事代谢疾病的免疫转录调控机制的相关研究。两课题组现招收博士后若干名,欢迎感兴趣的应届博士生发邮件联系。
强力教授:qiang@hsc.pku.edu.cn 汪丽恒教授:lihengwang@hsc.pku.edu.cn
撰稿:于乐翔

