学院新闻
郑瑞茂团队发现下丘脑RIIβ蛋白激酶A参与脂肪组织褐变调控新机制
2022年12月18日,北京大学JDB电子官方网站郑瑞茂研究员团队在Advanced Science杂志在线发表了题为RIIβ-PKA in GABAergic Neurons of Dorsal Median Hypothalamus Governs White Adipose Browning的研究论文。该研究,报道下丘脑背内侧核γ-氨基丁酸(GABA)能神经元RIIβ-PKA信号对脂肪组织褐变的调控机制,揭示了PKA发挥脂代谢稳态调控作用的特异脑神经结构与相关分子组学机理(见下图)。
白色脂肪组织褐变(browning of white adipose tissue)对优化脂代谢稳态发挥重要作用。该现象是指:在白色脂肪组织内存在一种“米色脂肪前体细胞”;寒冷等因素可激活这些细胞,导致这些细胞线粒体增多及“解偶联蛋白1”(uncoupling protein 1, UCP1)含量升高;在该过程中,白色脂肪组织的颜色会由白色变为米色或淡褐色,因而称之为“白色脂肪组织米色化”或“白色脂肪组织褐变”。该过程可加速脂肪分解代谢,增强机体产热量与能量消耗,降低体内脂肪蓄积量,从而发挥抵抗肥胖作用。神经因素密切参与调控该过程,但机制不清。因此,探索调控脂肪组织褐变的关键神经结构,并解析其内在机理,对预防和治疗肥胖及其并发症,具有重要理论意义和临床应用价值。
蛋白激酶A(protein kinase A,PKA)又称依赖于cAMP的蛋白激酶A(cyclic-AMP dependent protein kinase A),其在下丘脑参与脂代谢稳态的中枢调控。该团队前期研究发现,敲除PKA的RIIβ亚基基因(RIIβ KO)会使小鼠具有突出的优秀代谢表型:虽然其摄食保持正常水平,但机体脂肪含量显著减少,呈现消瘦(leanness)的低脂状态,并可抵御高脂食物诱导的肥胖;然而引发RIIβ KO小鼠这些代谢表型的神经与分子机理,均不清楚。
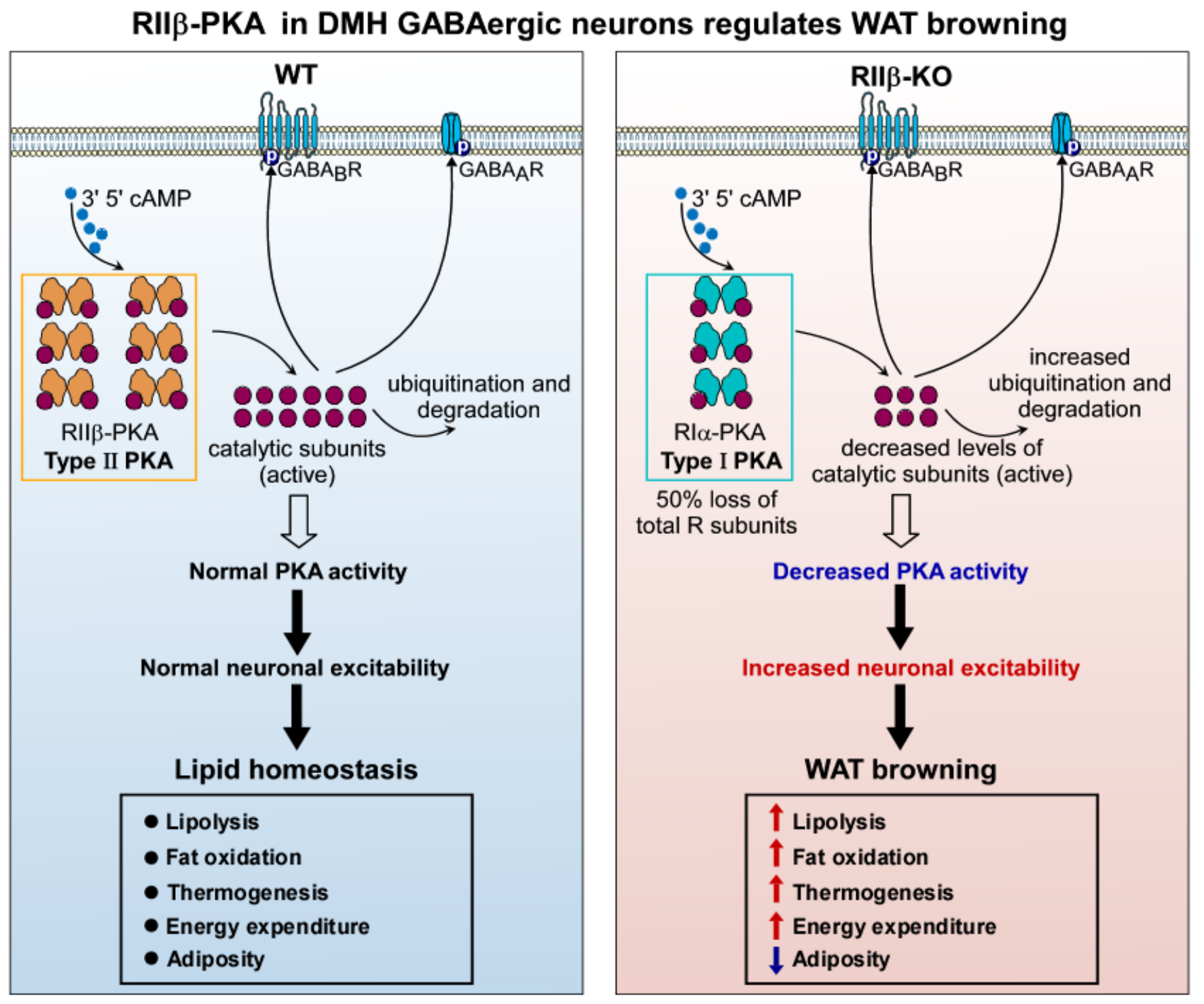
机制图:下丘脑背内侧核GABA能神经元RIIβ-PKA信号参与脂肪米色化的调节机制 图片引自:Wang, B., Zhao, M., et al. Advanced Science (2022)
该研究团队发现,RIIβ KO小鼠存在显著的白色脂肪组织褐变表型,将RIIβ基因特异再表达于下丘脑背内侧核GABA能神经元,则RIIβ KO小鼠褐变表型消失,证实下丘脑背内侧核GABA能神经元是PKA调控脂肪褐变的关键神经元。单细胞测序揭示:下丘脑背内侧核GABA能神经元活性增加是脂肪褐变增强的重要中枢神经机制之一。用化学遗传学、光遗传学方法激活下丘脑背内侧核GABA能神经元,可诱导白色脂肪组织褐变,抵御肥胖;不仅如此,生物信息学分析进一步揭示:下丘脑背内侧核GABA能神经元PKA活性降低,是引发脂肪褐变的分子机制。用基因点突变、神经药理学方法抑制下丘脑背内侧核GABA能神经元PKA活性,同样可诱导白色脂肪组织褐变,抵御肥胖。
综上所述,该研究提示,下丘脑背内侧核GABA能神经元PKA活性降低、及其所引起的GABA能神经元活性增强,是白色脂肪组织褐变的重要驱动因素。该研究丰富了PKA调控脂代谢稳态的中枢神经机制,为肥胖的预防和治疗提供了新参考。
北京大学JDB电子官方网站王炳蔚博士为该论文第一作者,郑瑞茂研究员为通讯作者。该研究是在人体解剖与组织胚胎学系、北京大学神经科学研究所、教育部神经科学重点实验室、国家卫生健康委员会神经科学重点实验室平台上完成的,同时也得到国家自然科学基金、北京市自然科学基金、北京大学科研启动基金的支持。
原文连接:https://doi.org/10.1002/advs.202205173(北京大学JDB电子官方网站)

