学院新闻
夏朋延课题组揭示非经典NLRP3炎症小体激活新机制
2023年3月30日,北京大学医学部JDB电子官方网站夏朋延研究团队、中国科学院微生物所王硕研究团队合作在Immunity发表题为“The orphan receptor Nur77 binds cytoplasmic LPS to activate the non-canonical NLRP3 inflammasome”的研究论文。该研究针对非经典NLRP3炎症小体激活途径的分子机制开展了深入的探索。该研究鉴定了全新的脂多糖胞内受体Nur77蛋白,并验证了其对于非经典通路的重要作用,对桥接caspase-11活化和NLRP3活化的中间过程进行了深度的阐释,对该领域的重要机制进行补充,有望为败血症治疗开发提供新的靶点。
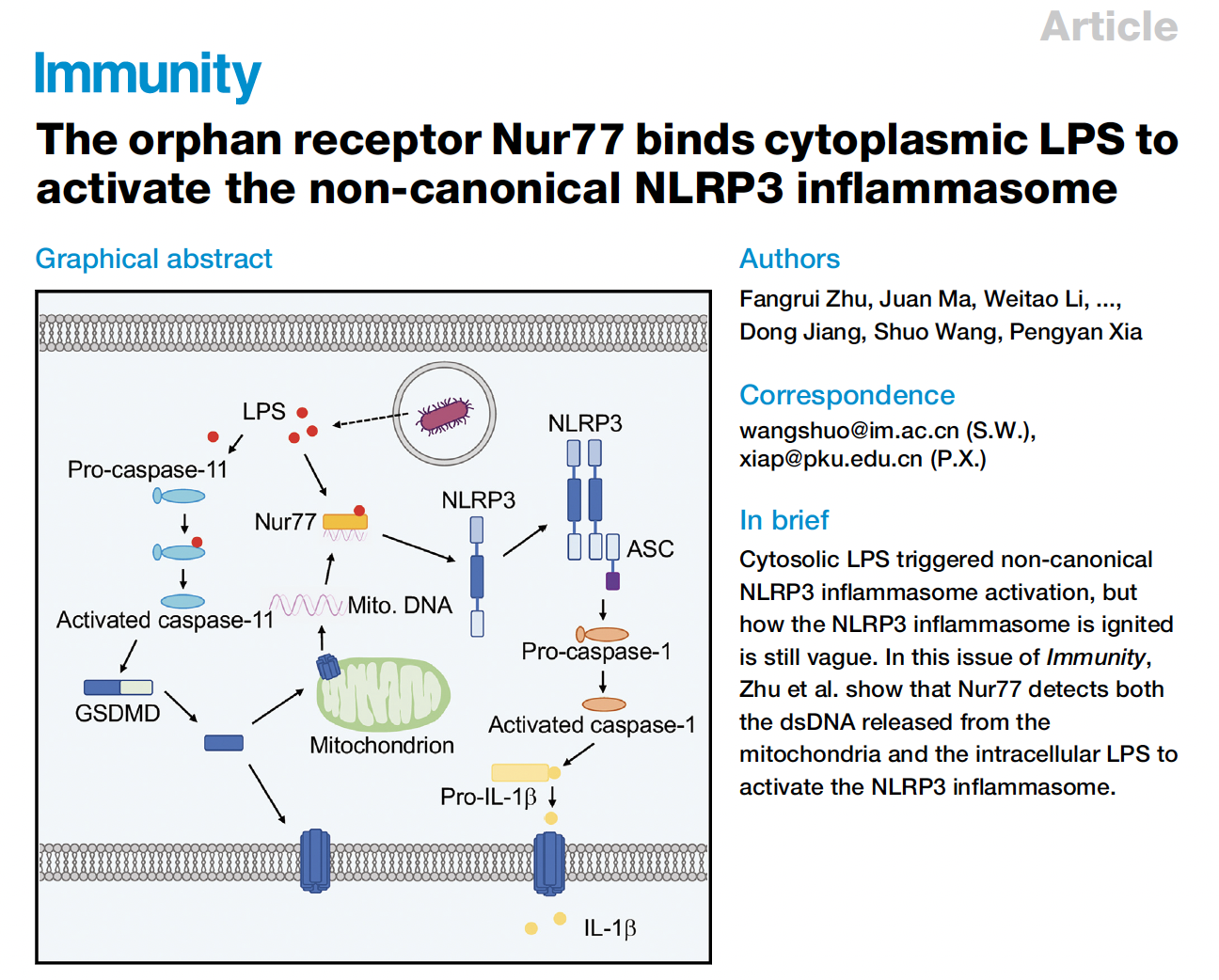
Caspase-11可以识别胞内的脂多糖LPS,引起GSDMD的活化,进而激活NLRP3炎症小体,引发caspase-1的切割和IL-1b的释放,这种免疫反应是宿主对病原体感染响应过程中的重要一环。但是caspase-11具体是通过何种机制引起NLRP3的活化,一直是本领域亟待解决的难题。本研究利用质谱分析手段鉴定出LPS的胞内结合蛋白,并构建候选蛋白的iBMDM敲除细胞株,在给予胞内LPS刺激后,发现Nr4a1敲除的细胞IL-1b的分泌减少但细胞焦亡不受影响。且Nr4a1–/– BMDM细胞在转入LPS后caspase-11和GSDMD活化正常但caspase-1没有活化,说明Nur77在caspase-11的下游和NLRP3的上游发挥作用。在受到胞内LPS刺激的BMDM细胞中,可以检测到Nur77与NLRP3的相互作用,并且通过免疫荧光染色,观察到细胞内Nur77与NLRP3的共定位。说明在炎症小体非经典激活过程中Nur77通过与NLRP3相互结合调控通路激活。研究者发现只有在LPS和包含NBRE的dsDNA同时存在时,Nur77可以结合NLRP3。而在NLRP3非经典激活模型中,GSDMD在线粒体上打孔使线粒体DNA释放入胞浆,对于活化Nur77是重要的。Gsdmd缺失的细胞受到胞内LPS刺激后,Nur77不再能结合NLRP3。缺失LPS结合位点或DNA结合位点的Nur77不能促进NLRP3的活化。研究者也检测了Nur77在败血症模型中的作用,给经过poly(I:C)预处理的野生型和Nr4a1–/–小鼠注射LPS,发现Nr4a1–/–小鼠血清中的IL-1b减少。分离小鼠的腹腔巨噬细胞后发现Nr4a1–/–对细胞焦亡无影响。在注射致死剂量的LPS后Nr4a1–/–小鼠存活更久,说明Nur77促进了宿主对内毒素的反应。
该研究的第一完成单位是北京大学医学部JDB电子官方网站,北京大学医学部JDB电子官方网站免疫学系夏朋延研究员、中国科学院微生物所王硕研究员是本文的共同通讯作者。北京大学医学部JDB电子官方网站2015级基础八年制朱芳蕊、马娟、2016级基础八年制李维涛、北京大学JDB电子官方网站博士研究生刘倩女是本文的共同第一作者。本研究得到国家重点研发展计划、国家自然科学基金、中国科学院战略性先导科技专项资助、中国科学院“前沿科学重点研究计划”、中国科学院稳定支持基础研究领域青年团队、北京市自然科学基金等经费资助。
全文链接:https://www.cell.com/immunity/fulltext/S1074-7613(23)00123-1
(北京大学JDB电子官方网站)

