科研动态
化疗是临床上治疗肿瘤的主要手段之一。它通过杀死或抑制癌细胞的生长和分裂,从而达到控制肿瘤、减小肿瘤体积或缓解症状的目的。然而肿瘤细胞反复接受化疗药物导致的化疗耐药问题极大地限制了其对肿瘤细胞的杀伤效果。目前化疗药物耐药的机制主要包括:药物外排,药物代谢改变,表观遗传的改变和肿瘤的异质性等。但是化疗药物耐药的发生与肿瘤微环境之间的联系却鲜有报道。肿瘤细胞自身能否通过影响肿瘤微环境进而影响化疗药物的疗效也尚不明确。环磷酸鸟苷-腺苷酸合成酶(cyclic guanosine monophosphate-adenosine monophosphate synthase,cGAS)是细胞质中一个DNA传感器,能够识别非自身DNA,并通过生成环状GMP-AMP (cGAMP)来激活STING通路,进而引发干扰素等免疫反应。近年来研究发现其在肿瘤免疫相应中也发挥着重要功能。然而在肿瘤化疗过程中,化疗药物介导的cGAS所参与的肿瘤免疫调控尚不明确。因此,揭示具体的调控机制将有助于明确化疗药物的免疫调节潜力,并可能为新的抗癌免疫治疗策略提供依据。
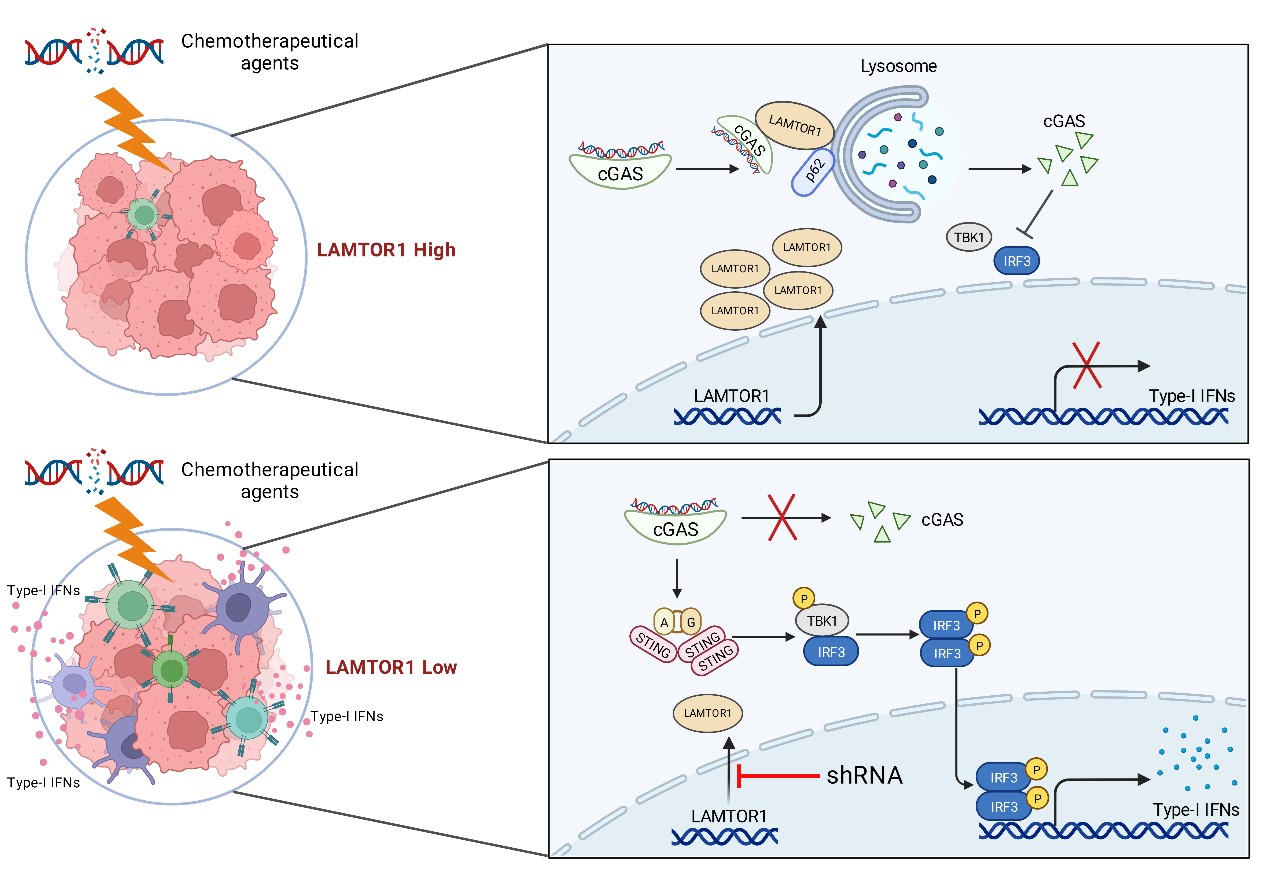
2024年10月3日,北京大学JDB电子官方网站罗建沅教授联合北京大学人民医院申占龙教授和丽水市中心医院纪建松教授课题组联合在PNAS杂志上发表了题为“LAMTOR1 ablation impedes cGAS degradation caused by chemotherapy and promotes antitumor immunity”的最新研究成果。此研究发现化疗药物诱导的双链DNA片段会促进LAMTOR1-cGAS-p62复合物的形成,促进cGAS的溶酶体途径降解,从而抑制cGAS信号通路的激活以及IFN-β的产生,进而削弱化疗药物诱导的抗肿瘤免疫。而LAMTOR1的缺失能增强肿瘤微环境中抗肿瘤T淋巴细胞的浸润,进而抑制肿瘤生长并延长荷瘤小鼠的生存期。

为了探索化疗药物对cGAS蛋白水平的影响,研究人员选取乳腺癌或直肠癌病人化疗前后的肿瘤组织进行免疫组织化学(Immunohistochemistry,IHC)染色。结果显示,cGAS的蛋白水平在化疗后降低。通过构建荷瘤小鼠以及肿瘤细胞系的给药模型,进行蛋白免疫印迹实验,发现多种化疗药物都能够使肿瘤细胞中的cGAS蛋白水平降低;而荧光定量PCR实验却发现化疗药物使cGAS的mRNA水平升高。这说明化疗药物是通过促进cGAS蛋白的降解从而降低肿瘤细胞中cGAS的蛋白水平。进一步的实验发现,化疗药物诱导的cGAS蛋白降解可以被溶酶体抑制剂而非蛋白酶体抑制剂阻滞,说明化疗药物诱导的cGAS蛋白降解是由溶酶体途径介导。为了找到在化疗药物处理的情况下,介导cGAS进入到溶酶体中降解的中间蛋白,研究人员采用蛋白免疫沉淀/蛋白质谱分析鉴定出了一系列在化疗药物(5-氟尿嘧啶)处理后与cGAS结合增强的蛋白,并与已知的溶酶体定位蛋白取交集,最后鉴定出晚期内体/溶酶体接头蛋白和MAPK和MTOR激活蛋白1(Late Endosomal/Lysosomal Adaptor and MAPK And MTOR Activator 1,LAMTOR1)可能介导了化疗药物诱导的cGAS溶酶体途径降解。利用蛋白免疫共沉淀,GST pull-down,免疫荧光以及微量热泳动(MicroScale Thermophoresis,MST)等实验确证了LAMTOR1与cGAS之间存在相互作用,并且化疗药物诱导的双链DNA片段能增强两者的结合并促进LAMTOR1的表达。最后,通过基因沉默和过表达实验,确定了化疗药物诱导的cGAS蛋白降解是由LAMTOR1介导的。由于LAMTOR1并不是溶酶体选择性降解途径中的经典受体蛋白,所以LAMTOR1可能只是作为骨架蛋白,通过增强cGAS与受体蛋白的结合,从而促进cGAS进入溶酶体被降解。为了鉴定出该受体蛋白,研究人员将LAMTOR1相互作用蛋白组与cGAS相互作用蛋白组取交集,发现已被报道的溶酶体受体蛋白SQSTM1/p62是LAMTOR1与cGAS共同的结合蛋白。通过免疫共沉淀和免疫荧光等实验,证实了LAMTOR1能够增强cGAS与p62的结合,进而促进cGAS被招募到溶酶体中降解。cGAS的主要功能是识别胞浆中的双链DNA,激活下游STING-TBK1-IRF3通路,启动干扰素-β(Interferon-beta,IFN-β)的转录。于是,通过荧光定量PCR,荧光素酶报告基因检测和转录组测序等实验,研究人员证明了LAMTOR1的缺失能够促进cGAS通路的激活,以及IFN-β的表达。进一步通过小鼠成瘤实验、组织免疫荧光和流式细胞术等实验发现LAMTOR1的缺失可以增加肿瘤微环境中抗肿瘤T淋巴细胞的浸润,进而抑制肿瘤的生长。最后,研究人员发现LAMTOR1的缺失能与免疫治疗或化疗产生显著的协同作用,最大程度地抑制肿瘤的生长。
本研究首次发现LAMTOR1是cGAS的结合蛋白,LAMTOR1通过下调cGAS的蛋白水平来抑制抗肿瘤免疫。LAMTOR1的缺失能通过增强cGAS介导的抗肿瘤免疫抑制小鼠肿瘤的生长并延长荷瘤小鼠的生存期。本研究为通过靶向LAMTOR1设计新型的抗肿瘤药物提供了理论依据。
北京大学JDB电子官方网站已毕业博士生,北大医学部(泰州)医药健康产业创新中心高级研究员别俊涛博士和北京大学JDB电子官方网站已毕业博士生李雨桐博士为该论文的共同第一作者。北京大学JDB电子官方网站罗建沅教授、北京大学人民医院申占龙教授、丽水市中心医院纪建松教授为共同通讯作者。感谢北京大学医药卫生分析中心的苏黎老师和娄雅欣老师对该课题的帮助以及国家自然科学基金面上项目和浙江省自然科学基金项目对该研究的资助与支持。
文章链接:https://www.pnas.org/doi/10.1073/pnas.2320591121

