科研动态
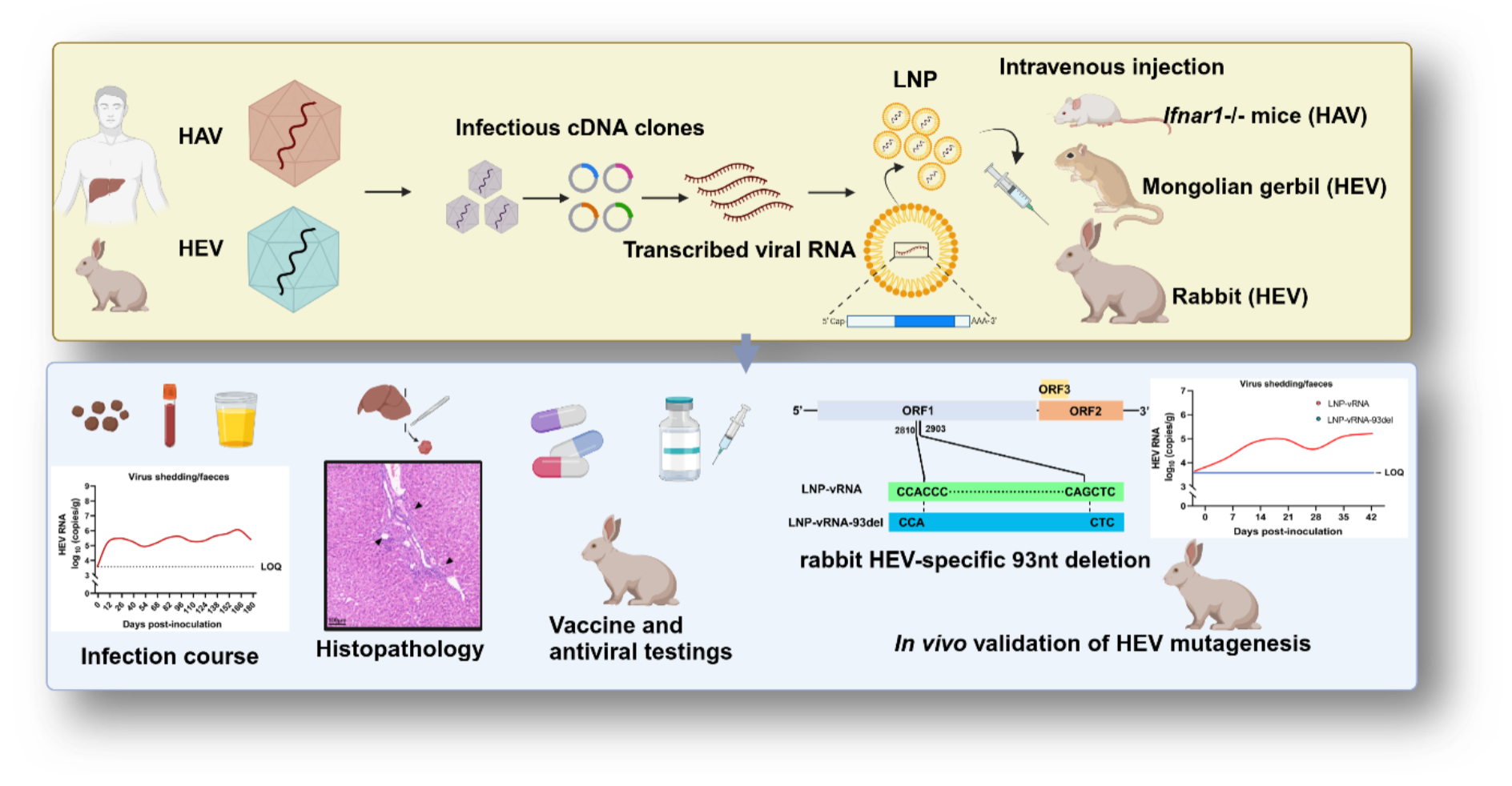
2024年10月1日,以北京大学JDB电子官方网站病原生物学系为第一完成单位,军事科学院军事医学研究院秦成峰研究员团队与北京大学鲁凤民/王麟研究团队合作在胃肠道肝病领域期刊Gut上发表题为“Establishment of enterically transmitted hepatitis virus animal models using lipid nanoparticle-based full-length viral genome RNA delivery system”的研究论著(Originalresearch)。该研究通过详细的实验在多种动物模型中证明了,利用脂质纳米颗粒(LNP)包裹病毒全长基因组RNA(LNP-vRNA),可以成功建立经肠道传播的肝炎病毒——HAV和HEV的体内感染。这种稳定的、标准化的LNP-vRNA系统,为利用动物模型研究肝炎病毒的病原学、致病机制和诊防治手段研发提供了有力的平台,并可在未来进一步将该方法扩展到其他不易在体外培养的病毒研究中。该研究提出了一种体内感染模型建立的新范式。

甲型肝炎病毒(HAV)和戊型肝炎病毒(HEV)是人类急性病毒性肝炎最常见的病原体。据WHO估计,2016年,全世界约有7134人死于甲型肝炎(占病毒性肝炎死亡率的0.5%),最近在发达地区观察到甲型肝炎发病率增加,主要通过性传播。全球每年约有2000万HEV感染和330万有症状病例。近年来,免疫功能低下患者中出现了慢性HEV感染并可快速进展为肝硬化的病例。与此同时,尽管HAV和HEV疫苗已在部分流行地区获得许可,但目前还没有针对这两种病毒的特异性抗病毒药物。快速建立病毒感染动物模型对研究发病机制及评估候选疫苗和抗病毒药物均具有重要意义。由于HAV和HEV等人类肝炎病毒在体外难以高效培养,分离和获得高载量野生型毒株困难,现阶段所用的感染方式主要通过直接从患者或感染动物的粪便或肝脏样本直接制备用于接种的毒株。此外,利用反向遗传系统,可通过将体外转录的全长病毒转录本以肝内注射的方式进行动物感染,但此操作有创、且耗时,并对操作熟练度要求高,在效率、一致性和质控等方面阻碍了感染动物模型的高效、大样本量建立。因此,迫切需要一种无需体外培养、可靠、快速的方法来建立体内感染。
合作团队通过将体外转录后加帽的全长HAV和HEV基因组RNA包裹于LNP中,通过静脉注射的方式分别接种到Ifnar1-/-小鼠、兔子和长爪沙鼠中,分别建立了HAV和HEV 的感染模型。LNP-vRNA (HAV) 感染小鼠可出现粪便排毒、肝组织核酸阳性、血清抗体阳转、血清ALT水平升高、肝脏组织病理学损伤等与临床急性甲型肝炎患者相似的临床表现及病毒学动态变化。LNP-vRNA (HEV) 接种兔子或长爪沙鼠后同样可出现粪便排毒、尿液抗原阳转、病毒血症、血清抗体阳转、肝脏组织病理学损伤等与临床急性戊型肝炎患者相似的临床表现及病毒学动态变化,免疫组化实验还可观察到兔子肝脏组织中HEV ORF2蛋白的表达。同时,研究团队还在兔子感染模型中发现,LNP-vRNA (HEV) 感染呈现剂量依赖性。同时,研究还验证了该LNP-vRNA系统建立的HEV感染模型可用于抗病毒药物及疫苗效果的评估。
该模型的另一项重要优势是可在分子水平对病毒基因组进行编辑和改造,研究团队通过删除性突变的方式构建了兔HEV特异性片段——ORF1中93-nt的缺失质粒,并通过LNP递送系统进行了兔子接种,接种后发现缺失突变组仅呈现一过性粪便排毒且各组织内HEV RNA水平显著降低。以上结果表明,ORF1中93-nt的缺失对兔HEV具有致死性。总之,研究中的递送方法可以成功地应用于HEV诱导突变的体内功能验证研究,并将促进对分子病毒学的进一步了解。
研究图片摘要
综上,研究团队开发了一个全新的平台,可以使用LNP递送全长病毒基因组,在体内快速、无需细胞培养的建立经肠道传播的肝炎病毒感染。建立的动物感染模型可用于野生型病毒的快速扩增、发病机制研究、抗病毒药物及疫苗评估和分子病毒学研究。同时,为未来其他病毒研究使用该平台提供了思路。
军事科学院军事医学研究院秦成峰研究员和北京大学JDB电子官方网站病原生物学系王麟助理教授为本文通讯作者。北京大学JDB电子官方网站八年制博士研究生刘天旭和清华大学JDB电子官方网站与军事医学研究院联合培养博士研究生李剑为本文共同第一作者。该研究还得到了北京大学鲁凤民教授和中国农业科学院哈尔滨兽医研究所的尹鑫研究员的重要帮助。
全文链接:https://gut.bmj.com/content/early/2024/10/01/gutjnl-2024-332784

